Quimica
jueves, 31 de marzo de 2011
Espectros Atómicos
Cada átomo es capaz de emitir o absorber radiación electromagnética, aunque solamente en algunas frecuencias que son características propias de cada uno de los diferentes elementos químicos.
Si, mediante suministro de energía calorífica, se estimula un determinado elemento en su fase gaseosa, sus átomos emiten radiación en ciertas frecuencias del visible, que constituyen su espectro de emisión.
Si el mismo elemento, también en estado de gas, recibe radiación electromagnética, absorbe en ciertas frecuencias del visible, precisamente las mismas en las que emite cuando se estimula mediante calor. Este será su espectro de absorción.
Se cumple, así, la llamada Ley de Kirchoff, que nos indica que todo elemento absorbe radiación en las mismas longitudes de onda en las que la emite. Los espectros de absorción y de emisión resultan ser, pues, el negativo uno del otro.
Puesto que el espectro, tanto de emisión como de absorción, es característico de cada elemento, sirve para identificar cada uno de los elementos de la tabla periódica, por simple visualización y análisis de la posición de las líneas de absorción o emisión en su espectro.
Estas características se manifiestan ya se trate de un elemento puro o bien combinado con otros elementos, por lo que se obtiene un procedimiento bastante fiable de identificación.
Podemos, en definitiva, identificar la existencia de determinados elementos químicos en la composición de sistemas inaccesibles, como pueden ser objetos astronómicos, planetas, estrellas o sistemas estelares lejanos, aparte de que, también, y debido al Efecto Doppler-Fizeau, podemos establecer una componente de velocidad de acercamiento o alejamiento de nosotros.
En la tabla Periódica los espectros atómicos son:
-Hidrógeno
-Litio -Berilio -Escandio
-Sodio -Magnesio -Ytrio
-Potasio -Calcio -Lantanio
-Rubidio -Bario -Actanio
-Cesio -Estoncio -Titanio
-Francio -Radio -Zirconio
-Etc...
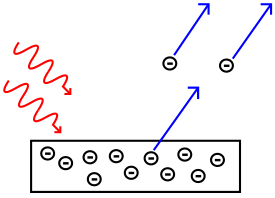
Efecto fotoeléctrico
El efecto fotoeléctrico consiste en la emisión de electrones por un material cuando se hace incidir sobre él radiación electromagnética (luz visible o ultravioleta, en general). A veces se incluyen en el término otros tipos de interacción entre la luz y la materia:


Max Planck
Max Karl Ernest Ludwig Planck (Kiel, Alemania, 23 de abril de 1858 – Gotinga, Alemania, 4 de octubre de 1947) fue un físico alemánconsiderado como el fundador de la teoría cuántica y galardonado con el Premio Nobel de Física en 1918.

En 1900 Max Planck trataba de resolver el problema de la radiación de cuerpo negro, con la física clásica los resultados eran catastróficos, pero a Planck se le ocurrió una de las ideas mas extrañas y brillantes de la historia, supuso que la energía no variaba en forma continua sino con "saltitos" a los que llamó "Cuanta"
La energía de un cuanta o cuanto es
E = h Nu
Donde h es la constante de Planck y Nu la frecuencia de la radiación.
La hipótesis de Planck es que la energía solo puede tomar valores enteros de la energía de un cuanta, es decir
E = n h Nu
n = 1, 2, 3,....
Esto es en apariencia muy simple pero revolucionó la física del siglo veinte, sentando las bases de la "Mecánica Cuántica"
Todos los experimentos posteriores dieron solidez a la teoría y se encontraron valores cada vez mas exactos de h la constante de Planck, que como dijimos, es el factor de proporcionalidad de las ecuaciones descriptas.

En 1900 Max Planck trataba de resolver el problema de la radiación de cuerpo negro, con la física clásica los resultados eran catastróficos, pero a Planck se le ocurrió una de las ideas mas extrañas y brillantes de la historia, supuso que la energía no variaba en forma continua sino con "saltitos" a los que llamó "Cuanta"
La energía de un cuanta o cuanto es
E = h Nu
Donde h es la constante de Planck y Nu la frecuencia de la radiación.
La hipótesis de Planck es que la energía solo puede tomar valores enteros de la energía de un cuanta, es decir
E = n h Nu
n = 1, 2, 3,....
Esto es en apariencia muy simple pero revolucionó la física del siglo veinte, sentando las bases de la "Mecánica Cuántica"
Todos los experimentos posteriores dieron solidez a la teoría y se encontraron valores cada vez mas exactos de h la constante de Planck, que como dijimos, es el factor de proporcionalidad de las ecuaciones descriptas.
¿Que se entiende por radiación electromagnética?
Características y limitaciones de cada modelo.
Características del Modelo de Dalton:
Introduce la idea de la discontinuidad de la materia, es decir, ésta es la primera teoría científica que considera que la materia está dividida en átomos (dejando aparte a precursores de la Antigüedad como Demócrito y Leucipo, cuyas afirmaciones no se apoyaban en ningún experimento riguroso).
Los postulados básicos de esta teoría atómica son:
Los postulados básicos de esta teoría atómica son:
1. La materia está dividida en unas partículas indivisibles e inalterables, que se denominan átomos.
2. Todos los átomos de un mismo elemento son idénticos entre sí (presentan igual masa e iguales propiedades).
3. Los átomos de distintos elementos tienen distinta masa y distintas propiedades.
4. Los compuestos se forman cuando los átomos se unen entre sí, en una relación constante y sencilla.
Las insuficiencias del modelo son las siguientes:
1. Se sabe que los átomos sí pueden dividirse y alterarse.
2. Las Experiencias de Thomson.
Características del Modelo de Thomson:
Introduce la idea de que el átomo puede dividirse en las llamadas partículas fundamentales:
.Electrones, con carga eléctrica negativa
.Protones, coCaracterísticas del Modelo
.Protones, coCaracterísticas del Modelo
Introduce la idea de que el átomo puede dividirse en las llamadas partículas fundamentales:
.Electrones, con carga eléctrica negativa
.Protones, con carga eléctrica positiva
.Neutrones, sin carga eléctrica y con una masa mucho mayor que la de electrones y protones.
Thomson considera al átomo como una gran esfera con carga eléctrica positiva, en la cual se distribuyen los electrones como pequeños granitos (de forma similar a las pepitas de una sandía)..Protones, con carga eléctrica positiva
.Neutrones, sin carga eléctrica y con una masa mucho mayor que la de electrones y protones.
Las insuficiencias del modelo son las siguientes:
- El átomo no es mazizo ni compacto como suponía Thomson, es prácticamente hueco y el núcleo es muy pequeño comparado con el tamaño del átomo, según demostro E. Rutherford en sus experiencias.n carga eléctrica positiva
.Neutrones, sin carga eléctrica y con una masa mucho mayor que la de electrones y protones.
Thomson considera al átomo como una gran esfera con carga eléctrica positiva, en la cual se distribuyen los electrones como pequeños granitos (de forma similar a las pepitas de una sandía)..Neutrones, sin carga eléctrica y con una masa mucho mayor que la de electrones y protones.
Las insuficiencias del modelo son las siguientes:
- El átomo no es mazizo ni compacto como suponía Thomson, es prácticamente hueco y el núcleo es muy pequeño comparado con el tamaño del átomo, según demostro E. Rutherford en sus experiencias.
Características del Modelo de Rutherfor:
En 1911, Rutherford introduce el modelo planetario, que es el más utilizado aún hoy en día. Considera que el átomo se divide en:
· Un núcleo central, que contiene los protones y neutrones (y por tanto allí se concentra toda la carga positiva y casi toda la masa del átomo).
· Una corteza, formada por los electrones, que giran alrededor del núcleo en órbitas circulares, de forma similar a como los planetas giran alrededor del Sol.
Los experimentos de Rutherford demostraron que el núcleo es muy pequeño comparado con el tamaño de todo el átomo: el átomo está practicamente hueco.
· Un núcleo central, que contiene los protones y neutrones (y por tanto allí se concentra toda la carga positiva y casi toda la masa del átomo).
· Una corteza, formada por los electrones, que giran alrededor del núcleo en órbitas circulares, de forma similar a como los planetas giran alrededor del Sol.
Los experimentos de Rutherford demostraron que el núcleo es muy pequeño comparado con el tamaño de todo el átomo: el átomo está practicamente hueco.
Insuficiencias del modelo de Rutherford:
1- Se contradecía con las leyes del electromagnetismo de Maxwell, las cuales estaban ampliamente comprobadas mediante numerosos datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (como es el electrón) debería emitir energía continuamente en forma de radiación, con lo que llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría; esto debería ocurrir en un tiempo muy breve.
Ernest Rutherford
Ernest Rutherford, barón Rutherford de Nelson, OM, PC, FRS, conocido también como Lord Rutherford (Brightwater, Nueva Zelanda, 30 de agosto de 1871 – Cambridge, Reino Unido, 19 de octubre de 1937), fue un físico y químico neozelandés. Se dedicó al estudio de las particulas radioactivas y logró clasificarlas en alfa, beta y gamma. Halló que la radiactividad iba acompañada por una desintegración de los elementos, lo que le valió ganar el Premio Nobel de Química en 1908. Se le debe un modelo atómico, con el que probó la existencia del núcleo atómico, en el que se reúne toda la carga positiva y casi toda la masa del átomo. Consiguió la primera transmutación artificial con la colaboración de su discípulo Frederick Soddy.

Rutherford descubrió que los átomos tenían núcleo y que el núcleo contenía la mayor parte de la masa y la masa de los electrones es casi nula.
Experimento de Rutherford:

El experimento consistió en mandar un haz de partículas alfa sobre una fina lámina de oro y observar cómo dicha lámina afectaba a la trayectoria de dichos rayos.
Como conclusión tenemos el modelo atómico de Rutherford:
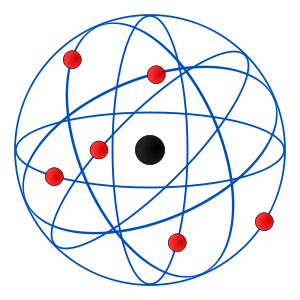
Que dice que existe un vacío entre el núcleo y los electrones y que estos a su vez se mueven rápidamente alrededor de el núcleo.

Rutherford descubrió que los átomos tenían núcleo y que el núcleo contenía la mayor parte de la masa y la masa de los electrones es casi nula.
Experimento de Rutherford:
El experimento consistió en mandar un haz de partículas alfa sobre una fina lámina de oro y observar cómo dicha lámina afectaba a la trayectoria de dichos rayos.
Como conclusión tenemos el modelo atómico de Rutherford:
Que dice que existe un vacío entre el núcleo y los electrones y que estos a su vez se mueven rápidamente alrededor de el núcleo.
Suscribirse a:
Entradas (Atom)